JES2011 症例の一年後の経過報告書
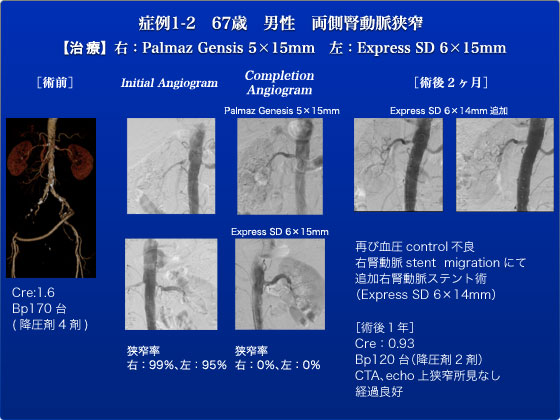
症例1、2は両側腎動脈狭窄症の症例でした。もともと右下肢間歇性跛行の症状に対して当科を紹介受診し、右CIA~EIAにかけてのCTOを指摘されたため、JES前に腸骨動脈領域のCTOに対しバイパス術を行いました。しかしその際に将来的に両側の腎動脈狭窄が治療適応となる可能性があることを考慮し、アクセスルート温存のためバイパスのinflowである左側のバイパス吻合部は外腸骨動脈に置き、ePTFEによる左外腸骨動脈-右総大腿動脈cross overバイパス術を行いました。バイパス術後間歇性跛行は改善し、ABIも右0.56/左1.04から0.97/0.98と改善を認めましたが、その後に術前1.0mg/dlであった血清Cr値が1.6mg/dlと上昇し、CT画像上両腎の軽度委縮、さらに降圧剤4剤内服するも血圧コントロール不安定となり、腎動脈狭窄の治療適応と判断し今回腎動脈ステント術を行うこととなりました。右腎動脈狭窄に対してはPalmaz Genesis 5×15mm、左腎動脈狭窄に対してはExpress SD 6×15mmを留置し、右99%・左95%の狭窄病変はともに0%まで改善を認めました。術後腎機能も血清Cr 1.07mg/dlまで改善し、一旦は降圧剤2剤内服で血圧管理も落ち着き経過良好となりました。術後2ヶ月の時点で血圧コントロールが再び不良となり、右腎動脈ステントの末梢側へのmigrationに伴い腎動脈起始部狭窄が再度出現したため、追加右腎動脈ステント術(Express SD 6×14mm)を行いました。右腎動脈が12時方向から立ち上がって屈曲して右方向に進むため末梢側に脱転したと考えられます。もう少し腎動脈ステントを大動脈内に出してdeployしておくべきであったと反省症例です。その後の経過は良好で、血圧コントロールも降圧薬2剤で再び良好となり、腎機能も正常で、エコー上もステント内再狭窄等の所見を認めず現在外来経過観察中となっています。
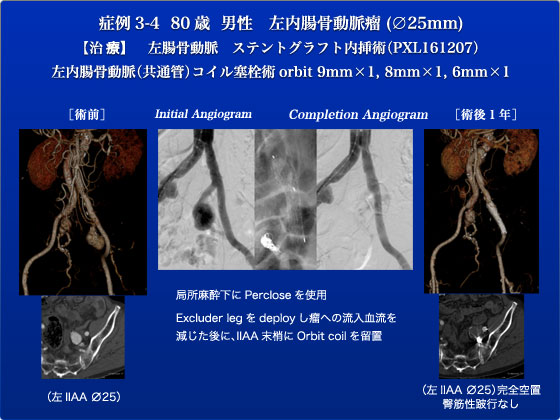
症例3、4は左内腸骨動脈瘤(IIAA)の症例で、2008年に当院でAAAに対し開腹Y-graft置換術後の症例でした。Y-graft置換術時には左IIAAが、20mmであったため左の末梢は総腸骨動脈に吻合しておりました。この20mmのIIAAが術後1年間で約5mmの増大傾向を示したため治療を行う方針となりました。この症例はカットダウンすることなく完全経皮的にステントグラフトおよびIIAAコイル塞栓を行う方針としました。造影用のカテーテルは右大腿動脈から挿入し、左大腿動脈はまず局所麻酔下にPercloseを使用し、大腿動脈止血用の糸かけを行った後に12Fr.シースを留置しました。Percloseは6Fr.のデバイスですがこうやって最初に糸かけを行っておくことで太いデバイス挿入後の止血も可能で、我々は大腿動脈の性状が許せば22Fr.までは同様の方法を行うことがあります。12 Fr.シースから左IIAAの末梢にカテーテルを誘導しコイル塞栓術を試みました。カテーテル誘導の際にはOrbit 2mmを血流に乗せて左IIAA末梢に誘導するいわゆる「ヨット部作戦」を試みましたが、血流が早くOrbitを上手くIIAA末梢に誘導できなかったためにまずKMPをIIAA末梢に留置した状態で左CIA-EIAにかけてExcluder leg(PXL161207)を先行してdeployし瘤への流入血流を減じた後に、留置してあったKMPをIIAA末梢に挿入し、Orbit 9mm,8mm,6mmをnon- selectiveにそれぞれ1個ずつ留置し、その後にMAXI 15mmにてステントグラフトのtouch upを行いました。確認造影で瘤が空置されていることを確認し手術を終了しました。Inflowをコントロールすることなくこのようにnon-selectiveにIIAをコイル塞栓しますと、IIA分枝に深く入り過ぎ、術後臀筋性跛行を惹起しますのでこうした手順で手術を進めました。術後経過は良好で第3病日に退院となり、退院時には軽度の左臀筋性跛行症状を認めておりましたが術後1ヶ月の時点で症状は消失し、左IIAAも完全に空置されており、極めて良好な経過を辿っています。このように総腸骨動脈瘤がある場合に外腸骨動脈にlandingする場合は、カテーテルやワイヤをIIAや総腸骨動脈に残したままステントグラフトをdeployして最後にコイルを行う方法も一つのオプションとして覚えておくと良いと思います。特にselective catheterizationを行う時間的余裕のない破裂症例の場合などで有用です。
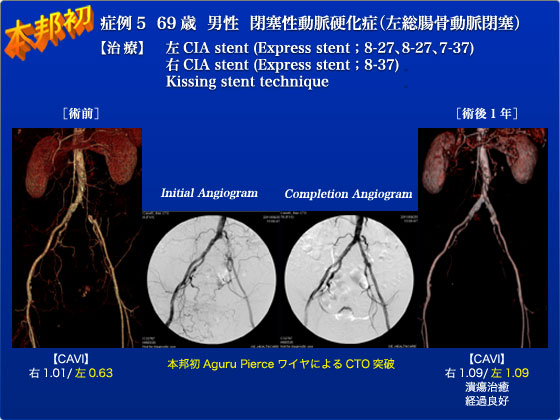
症例5は69歳の男性で、ASO(左CIA CTO病変)と下肢静脈瘤との混合型潰瘍の症例でした。足関節周囲(特に内果)の潰瘍は2008年2月から出現しているにも関わらず、他院では左下肢静脈瘤による潰瘍と診断され、弾性ストッキングの治療しかなされておりませんでした。当院での精査で初めてASOを合併している事が判明した症例でした。手術は対側CFAからPig-tailカテで血管造影を行い、collateralから造影される左CFAに血管造影ガイド下に穿刺し、シースを挿入しました。対側からは本邦初であるAguru pierceワイヤ(0.014)を用いて、また同側からはAstatoワイヤ(0.018)でCTO突破を図りました。AstatoワイヤでCTOを突破した後に、CIA末梢からExpress LD(7-37)、Express LD(8-27)を留置しました。確認造影を行うとCIA stent中枢端に狭窄(陰影欠損)を認め、IVUSで血栓が疑われた為、Thrombo basterで血栓除去を行いました。血栓は吸引できずに最終的にExpress LD(8-27)でkissing stentを行い手術終了となりました。術後経過ですが、術前触れなかった足背動脈が触知可能になり、ABIは0.61から1.03まで改善しました。肝心の潰瘍病変ですが、1年半治癒しなかった潰瘍が、術後4ヶ月目の外来で完治が確認されました。術後1年の現在でも再狭窄などはなく、足背動脈は良好に触知し、潰瘍病変の再燃を認めておらず、経過良好です。通常、内果に出来る潰瘍は静脈瘤に伴う静脈性潰瘍が多いのですが、本症例のように動脈性の要因が混じっていることもあり注意が必要であると改めて感じた症例でした。
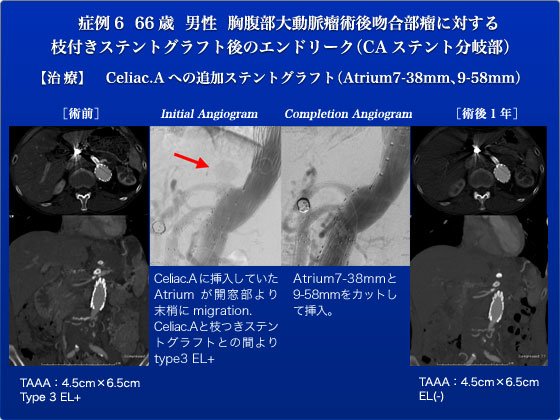
症例6は4年前に胸腹部大動脈瘤に対して枝付きステントグラフトを施行した症例です。胸部大動脈瘤で2回の手術歴があり、open repair不能ということで当方に紹介され、枝つきステントグラフトを行いました。その後第6回JESの4か月にも嚢状の肝動脈瘤が見つかりコイル塞栓術を施行しました。この術後に行ったCTで今まで認めなかったエンドリークが出現し今回手術の方針となりました。第6回JESでは時間の都合で皆さんと供覧することが出来ませんでしたが、翌日に手術を行いました。両鼠径部を局所麻酔し両大腿動脈に5Frシースを挿入しました。造影すると腹腔動脈と枝つきステントグラフトとの間よりエンドリークを認めました。腹腔動脈に挿入していたAritum covered stentが開窓部より末梢にmigrationしていました。恐らく数か月前に施行した肝動脈瘤コイルを挿入した手術の際に移動したものと思われました。右大腿動脈のシースを7Fr.Ansel Ⅰシースに交換、RDCカテーテル、KMPカテーテル、Kyoshaワイヤにて脾動脈へcannulationしました。その後シースをすすめAtrium covered stent7-38mmを挿入し開窓部をまたぐようにdeployしました。WANDA10-20mm、OptaP3バルン12-20mmにてtouch upしましたがエンドリークは消失しませんでした。そのためさらにAtirum covered stent9-58mmを挿入しConquest8- 20mmにてtouch upしたところエンドリークが消失しました。術後経過は順調で術後2日目に退院しました。枝付きステントグラフトの場合、この様な接合部からのエンドリークを認めることもありますので症例によっては枝の部分に短い「つば」がついたt-Branchが有用です。2012年の第7回JESではこのt-Branchを世界で初めてライブ中継する予定ですのでご期待してください。
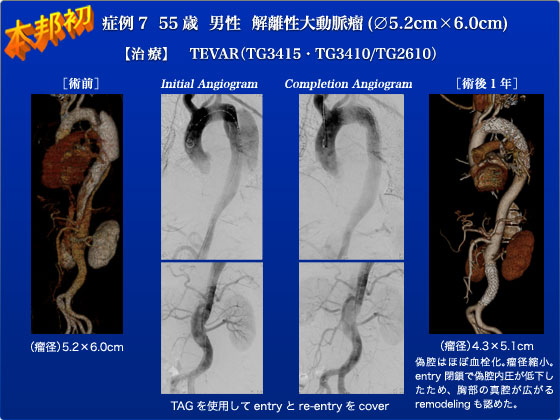
症例7は55歳男性で、2007年に大動脈解離(Stanford B型)を発症した慢性解離性大動脈瘤の症例です。胸部下行に大きなentry(primary tear)があり、同部の大動脈径が最大でした。当院紹介時(2009年)には4.5×5.0cmであり動脈瘤が小さいため経過観察をしていました。今回5.2×6.0cmに増大したことと5mm/半年以上の増大を認めたため、ステントグラフトでentry閉鎖を行う方針としました。造影してみると胸部下行の大きなentryとceliacおよび右RA近傍にre-entry、大動脈終末部にも比較的大きなre-entryを認めました。また、SMA、左RAは真腔で、celiacと右RAは真腔と偽腔の両方より造影されました。治療は、まず胸部下行のentryをステントグラフトを用いて閉鎖し、造影所見などで他のre-entryを閉鎖するかを検討する方針でした。偽腔圧のモニタリングのために偽腔に14Frを挿入しwireless pressure sensor (CardioMems)を留置しました。しかし、胸壁の厚みのためかwireless pressure sensorで圧を感知することができなかったため残念ながらモニタリングすることは困難でした。胸部下行のentryに対して、まず左SCAを温存するようにTAG(TG3415)を留置しました。しかし、わずかにtype1のエンドリークをみとめるため、左SCAをカバーするようにTAG(TG3410)を追加しエンドリークはなくなりました。Entry閉鎖は行えたため、この時点で手術を終了してもよかったのですが、腹部大動脈のやや大きめなre-entryも閉鎖したほうが良いと判断しました。Excluderのaortic extensionではre-entryの閉鎖が困難のため、TAG(TG2610)で閉鎖しました。complete exclusionを目指しceliacおよび右RA近傍の小さなre-entryをcovered stentで治療した場合、対麻痺の危険度も高くなると判断したため、今回はpartial exclusionで経過をみる方針としました。術後、腸管虚血、腎不全や対麻痺などの合併症もなく第6病日で退院となりました。術後半年後の造影CTでは胸部と腹部の偽腔はほぼ血栓化し、胸部下行の動脈瘤は4.3×5.1cmの縮小していました。さらに、entry閉鎖で偽腔内圧が低下したため、胸部の真腔が広がるremodelingも認めました。これを我々は真腔の凸サイン(nipple sign)と呼び、偽腔圧が高いことを示唆する凹サイン(dimple sign)とともにCAADの経過観察・予後推定に用いています。我々は大動脈瘤径が最大の場所、すなわちtarget lesionに最も近い部分のtearをまず閉鎖すべきと考えており、この症例は胸部下行の大動脈径が最大ですので、胸部下行のentryを閉じることが必須でそれ以外はオプションで躍起になってすべてのtearを閉鎖しに行く必要はないと考えました。現時点ではその考えが正しかったと言えると思いますが今後も経過を見ていく必要があるでしょう。
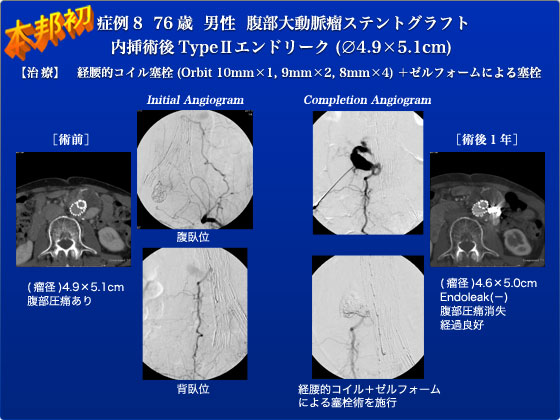
症例8は4年前にAAA(4.0×4.3cm)、右内腸骨動脈瘤(2.8×3.2cm)に対してEVAR(Zenith)+内腸骨動脈コイル塞栓を施行した症例で、経過観察中にType2エンドリークが持続し瘤径が増大(4.9×5.1cm)し圧痛を認めたため今回手術となりました。まず仰臥位で選択的造影を行うと、左内腸骨動脈-下殿動脈-第3腰動脈経由のType2エンドリークを認めました。その後、体位を背臥位とし棘突起から2横指左側よりHanakoのPTGBD針(18G)にて穿刺を行いました。瘤内に到達し逆血を確認し圧を測定すると、115/75mmHgであり体血圧と約40程度の圧較差を認めました。通常は穿刺したのちに造影すると数本の腰動脈が確認されることがほとんどですが、今回の造影では仰臥位で認めた第3腰動脈のみでした。ワイヤを挿入しKMP、prowlerマイクロカテーテルよりゼルフォームの注入ならびにOrbitによるコイル塞栓を行いました。術後の経過は順調で、術前に認めた圧痛は消失し術後4日目に退院となりました。EVARの普及に伴ってこのようなエンドリークの治療が増加してくると思われます。しかし、Type2エンドリークのうち瘤の拡大のないものは経過観察で十分で、この症例のように治療が必要となるのは瘤の拡大が見られる場合に限ることは忘れてはなりません。Type 2エンドリークは最悪破裂しても大多数において血行動態が保たれている事を併せて、全てのType2エンドリークを治療することはrisk/benefitの観点から正当化されないと考えています。
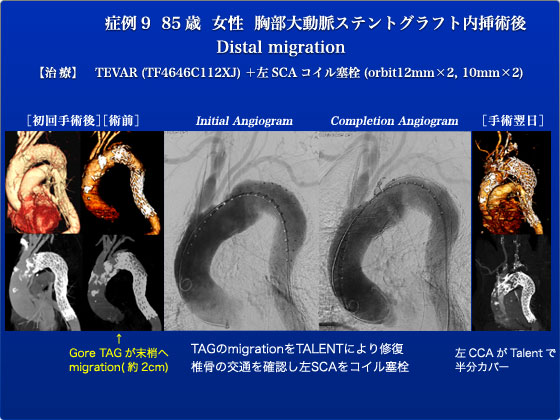
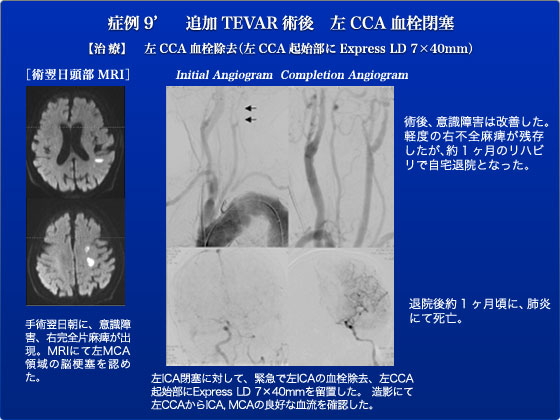
症例9は、85歳女性 胸部ステントグラフト術後distal migrationの患者です。遠位弓部瘤にて2008年3月に胸部ステントグラフト(Gore TAG)を施行されました。術後2年時にCT上、末梢へのmigration(約2cm)および瘤径拡大を認め、今回、追加ステントグラフト予定となりました。アクセス不良のため、左下腹部を皮切し、後腹膜経路で左総腸骨動脈を露出し、そこからステントグラフトを挿入しました。ステントグラフトは屈曲部でも部のBird’s Beakの少ないTalentを選択しました。Talent(TF4646C112XJ)を挿入し、左鎖骨下動脈(SCA)カバー、左総頸動脈(CCA)直下でdeployし、左SCAをコイル塞栓しました。造影上、エンドリークなく、左CCAはややカバーしているが、血流良好、拍動も良好であり、そのまま終了しました。手術後、覚醒良好、麻痺所は認めませんでしたが、術翌日朝に、意識障害、右完全片麻痺が出現、MRIにて左中大脳領域の脳梗塞、左内頚動脈(ICA)閉塞の所見がみられたため、緊急手術を施行しこの様子もJESで緊急中継しました。弓部からの造影にて左CCAはステントグラフトにより半カバーされ、左CCAはslow flow、左ICA閉塞の所見がみられました。左頸動脈をカットダウンし、2Fr Fogartyカテーテルにて左ICAの血栓除去を施行し、約4cm長の血栓が摘出されました。その後、良好なback bleedingが得られました。また、頸動脈から逆行性にCCA起始部にExpress LD 7×40mmを留置し、CCA血流を維持するようにしました。造影にて順行性の良好な血流を確認し、手術を終了しました。術後、意識障害は改善し、右片麻痺も術前より著明に改善しましたが、不全麻痺は残存し、リハビリを早期に開始しました。約1ヶ月のリハビリで麻痺はかなり改善し、自宅退院となりました。退院後約1ヶ月頃に、肺炎にて亡くなられたとの連絡がありました。TalnetはBirds’s beakが少ないdeviceとして弓部に使用し、「archゆえTalent」といってきましたがdeployment不安定で特に大口径の場合は正確な留置が難しいというデメリットがありました。改良されたValiant Captivaは最後に中枢側が開くようになっており正確な留置が可能となっております。今年のJESではこのValiantをお見せできると思います。なお、急性脳梗塞に対するライブ中継は前代未聞の珍事ですが、同時に示唆に富んだ症例でご覧になったみなさんも学び取る事があったとおもいます。
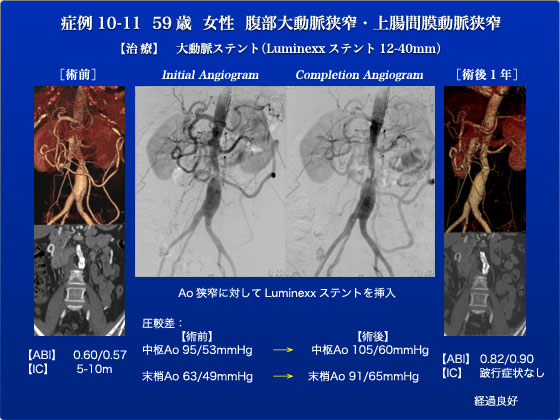
症例10-11は両側の間歇性跛行(5-10m)を主訴に来院した若年女性の患者さんです。高安病も疑われておりましたが、確定診断には至っていません。CTでは腎動脈下の腹部大動脈が6mmと著明に狭窄しておりました。さらにSMAにも狭窄を認めておりIMAは腹腔動脈からGDA、Riolanを介して逆行性に血流が供給されていました。まず5Frシースを上腕動脈から挿入し腹部大動脈造影を行いました。造影ではCTの通りの所見で、病変部の中枢と末梢では圧較差が30mmHgありました。上腕から造影したのちに右CFAの位置を確認し、こちらにも5Frシースを挿入しました。KMPにてIMAを造影するも逆行性血流のため起始部付近しか造影されませんでした。右CFAよりラジフォーカスワイヤにてlesion crossしKMPを追従させE-Luminexx12-40mmを挿入しました。後拡張はP3バルン8×2mmにて行いました。再度圧較差を測定すると10程度まで改善し、さらにIMAの血流は順行性となりRiolanにて拮抗(to and fro)するようになりました。術後は以前全く触知されなかった両側の足背動脈、後脛骨動脈が良好に触れるようになりました。1年経った今でも跛行症状は消失しており、患者は元気にしております。このように手術で症状が劇的に改善するのも血管病治療の醍醐味といえるのではないでしょうか。
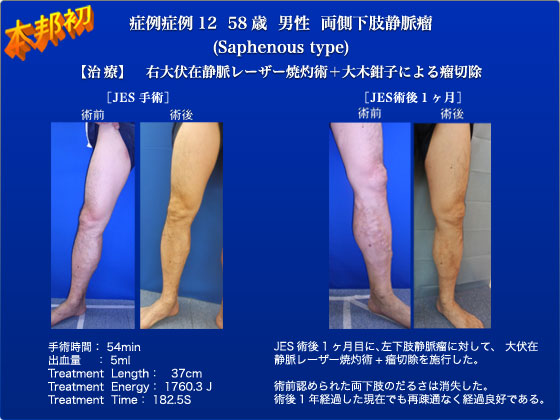
症例12は58歳、男性の両側下肢静脈瘤の患者です。両側の大伏在静脈の逆流と、下腿にCEAP分類でC2の瘤が認められました。本症例の手術は、JES史上初めて慈恵を飛び出し、銀座に新たに開設した銀座7丁目クリニックからの中継で行われました。2011年1月にようやく保険償還されたELVeSレーザーを用いて、右大伏在静脈に対するレーザー焼灼術を行いました。下腿の瘤に対しては、内視鏡の生検鉗子をmodifyした、通称「大木鉗子」を用いて瘤切を行っております。術後1か月目に左下肢の治療も行っております。両側ともに、日帰り手術であり、術前認められた下腿のだるさは消失し、再開通も認められず、経過良好であります。2011年5月9日に開設された銀座7丁目クリニックは、約8ヶ月で1000件を超えるレーザー治療を行いました。現在銀座7丁目クリニックは10人の血管外科医の外勤先となり、月約200件のレーザー焼灼術を行っております。ストリッピング術と比較し、入院が不要、局所麻酔のみで行える、治療成績が満足いくものである点などから、今後もレーザー治療は広がっていくものと考えております。ただほぼ全例に、レーザー術と同時に施行している瘤切が手間暇かかる割に診療報酬を請求できない現状をフェアにしてほしいと願っています。それと、保険診療で自己負担4万円程度でレーザー治療ができる現在も、自由診療下で保険のきかないレーザー機種を用いて、より優れているという美名のもと片脚30万円も請求しているクリニックが多数存在する事や、例外的ではありますが逆流がない大伏在静脈にこうした治療を勧めている医師がいることは遺憾で、下肢静脈瘤治療を長年担ってきた血管外科医が果たすべき責任は一層重いと思います。
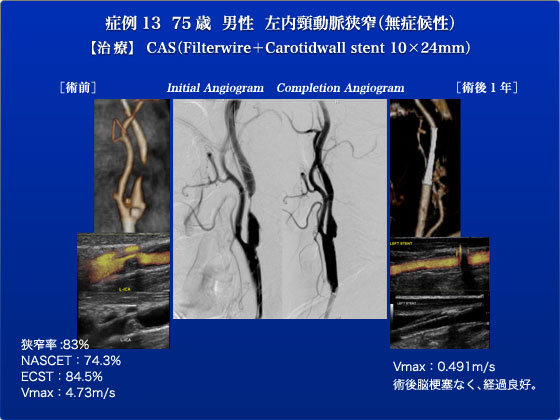
症例13は、無症候性の左内頸動脈高度狭窄症例に対してFilter wire越しに頸動脈ステント術を行った症例です。2008年10月に検診で指摘されて頸動脈狭窄に対して近医でfollow upされていましたが、2011年5月にエコー上での狭窄率83%と上昇したために当科を紹介されました。当科にて施行した頸動脈超音波では、NASCET法76.3%・ECST法84.5%の狭窄を認め、また同部位のPSVは4.73m/sと上昇しておりました。もともとアルツハイマー型認知症と診断されアリセプト内服中の症例であり微小な脳塞栓に対する予備能が極めて低いことや、認知症を悪化させる可能性がある全身麻酔を回避することが望ましいこと、またplaque自体の評価としてはplaque burdenが低くembolic riskが低いと考えられること等の点から頸動脈ステント術を選択しました。最初に頸動脈造影と脳血管造影で、左ICAの99%病変を確認しました。基本に忠実に左ECAにguidewireを挿入し、6Fr Destinationを左CCAに留置しました。Filter Wire EZを用いて左ICAの狭窄病変をcrossさせた後にfilterを展開し、VH-IVUSを行いました。lipid成分がそれほど多くない病変であり、頸動脈ステントを安全に行えると判断しました。filterを展開した状態でSterling 4×40mmでpre-dilationを行い、その後にCarotid WALLSTENT 10×24mmをICAからCCAにかけて留置しました。頸動脈反射に注意しながら、Sterling 5×20mmでpost dilationを行い、造影でno-flowやslow-flowなどもみとめず狭窄が解除されたことを確認しました。Filterがstentにひっかからないように回収し、脳血管造影でdefect、poolingがないことを確認しました。術後脳梗塞症状もみとめず、hyper-perfusionに留意し厳重な血圧管理を行った後に、降圧薬内服にて血圧管理良好となった時点で独歩退院となりました。術後MRIでも脳梗塞所見を認めず、また頸動脈echoでもステント再狭窄の所見を認めず、極めて良好な経過であり、現在も定期的に通院・経過観察中です。頸動脈狭窄の治療においてCEAが第一選択であり、このように末梢プロテクションでCASを行う症例は本症例のようなシンプルでかつ正当な言い訳がある症例に限定されるべきと考えております。
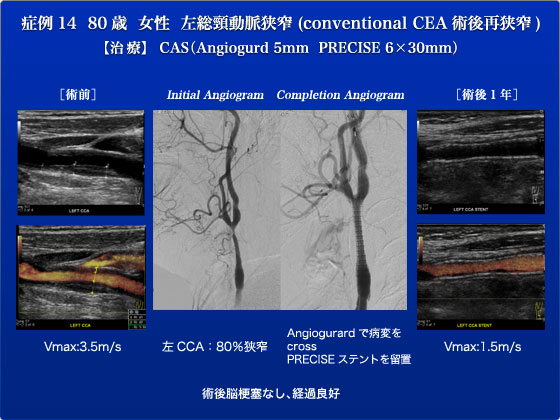
症例14は80歳、女性で左総頸動脈狭窄症の症例です。2010年10月に左CCA狭窄(約75%)に対し、conventional内膜剥離術(非eversion法、simple closure)施行しました。脳梗塞などの合併症は無く、術後4日目に退院しました。2011年4月に左頸部雑音を聴取し頸動脈超音波でPSV 3.5m/sと上昇していたため、CEA術後再狭窄と診断しました。Eversion法では再狭窄症例はゼロですが、本症例はconventional CEAのため再狭窄を認めたものとおもわれます。再度のCEAは行いづらいため、頸動脈ステント術を選択しました。まず、脳血管造影と頸動脈造影を行ない、左CCA(CEA後)の80%狭窄をみとめました。さらに、右ICAからA-comを介し左ACAが造影され、左A1欠損も疑われました。左CCA病変のため、ガイドワイヤー(ラジフォーカス)で病変を通過させた後、ガイディングシース(6Fr Destination)を左CCAに留置しました。Over the wireからmono railとなり扱いやすくなったAngioguardで再度病変をcrossしfilterを展開させ、VH-IVUSで線維性の狭窄病変とlanding zoneを確認しました。再狭窄病変のため、正確な留置が可能で拡張力の強めなPRECISEステントを留置しました。Angioguardの回収も問題なく、filter内には微小プラークは認めず、脳血管造影で脳梗塞を疑わせる所見もありませんでした。現在まで脳梗塞の発症はなく、1年後の評価でもステントの再狭窄は認めておりません。このようにCEA再狭窄例などのhostile neck症例にはCASは有用な場合があります。こういった複雑な病変の際は末梢プロテクションではなく、flow reversal deviceが威力を発揮する可能性があります。第7回JESではこのflow reversal deviceを用いたCASをご覧頂けると思います。
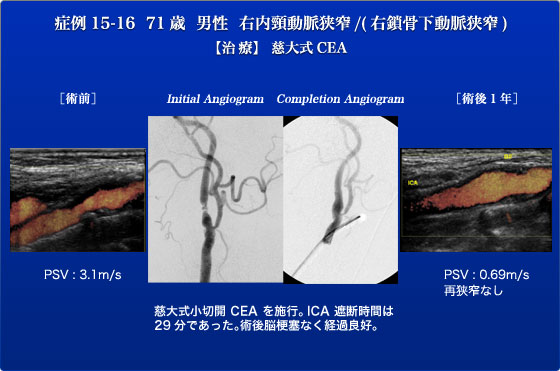
症例15,16は慈大式CEAの症例です。慈大式CEAは小切開で頸動脈を露出し、頸動脈遮断を行うまでICAをさわらずに、内膜剥離はeversion法で行う術式で現在まで100例を越える慈大式CEAを行い、術中脳梗塞ゼロを実現しております。この症例は2008年6月、症候性の左内頸動脈狭窄症に対し慈大式CEAを施行しました。その際より指摘されていた右内頸動脈狭窄が2011年6月の頸動脈超音波でPSV 3.1m/sと上昇し病変の進行を認めました。さらに右上肢の労作時易疲労感もあり、造影CTで右SCAの90%狭窄を認めました。右SCA狭窄の治療はCEA時に剥離したCCAを遮断することで脳梗塞を予防しながらおこなう方針としました。まず、おなじみとなりました3cmの世界最小の皮切でICA,ECA,CCAを剥離し、ICAを離断しeversion法でプラークを剥離する慈大式CEAを施行しました。ICA遮断時間も29minでシャントチューブも使用しませんでした。CEAの手術はすべてライブ中継しましたが手術時間は70分でした。つづいて、左SCA狭窄の治療を行おうとしましたが、第1日目に治療をおこなった症例9の緊急手術のためCEAのみで終了しました。術後経過良好で脳梗塞などの合併症もありませんでしたが、高血圧の管理に時間がかかり第10病日に退院となりました。右手の易疲労感の症状は、あまり気にならないとのことで経過観察のみ行っております。術後1年目の外来での頸動脈超音波で再狭窄はなく血流は良好に保たれております。
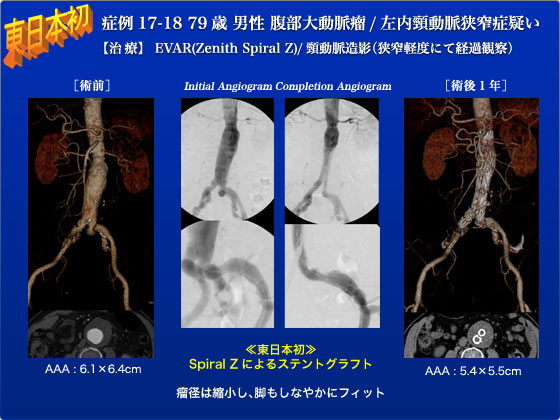
症例17,18は79歳の男性で、AAAと左内頸動脈狭窄の患者です。2011年3月近医にて超音波検査にてAAAを発見され、当院紹介となりました。CTAにて瘤径6.1cmのAAAと左ICA狭窄を認め、腹部ステントグラフトと頸動脈造影の予定で手術となりました。腸骨動脈の屈曲を認めたため、屈曲病変に対応可能な本邦初登場のCook Spiral Zを使用する予定としました。手術は、まず脳血管造影をおこないましたが、左ICAは軽度狭窄を認めるのみでした。つづいて、屈曲のため右アクセスにてZenithメインボディを留置後、左右CIA にSpiral Zを留置しました。挿入はきわめてスムースで最終造影にてエンドリークなく、脚のkinkも全く認めませんでした。術後経過は良好で、術後6日目に退院しました。術後1年のCTAでは、瘤径5.4cmと縮小傾向でエンドリークはなく、経過良好でありました。また、屈曲のみられたCIAは、Spiral Z挿入後も術前の形状をほぼ保っており、脚閉塞などの合併症もなく、しなやかにフィットしております。今までレッグ屈曲症例に対してはZenithメインボディにExcluderレッグを用いた例もありましたがこれが上市されるともうこういう異種ステントを使用するmix and match例が減るのではないかと思います。今後、早々に日本で使えるようになることを期待しています。
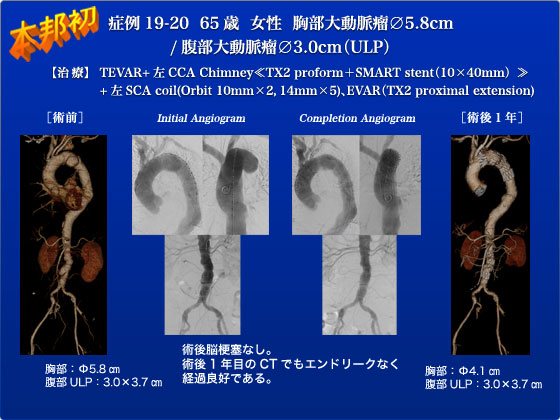
症例19,20は遠位弓部の嚢状瘤(5.8cm)と、腹部大動脈の限局性解離による嚢状瘤(3.0cm)に対してステントグラフト術を行った症例です。COPD精査のために施行したCTでTAAを指摘され、経過観察中に嗄声・背部痛出現したために当科を紹介受診されました。症候性の大きな嚢状のTAAに対して準緊急的でTEVARを行う方針となりました。腹部大動脈にも限局性解離による嚢状瘤を認めるため、3本あった左腎動脈のうち最も低位のアクセサリー血管をsacrificeすることでneckを確保し、TX2 proximal extension(TBE-26-80-JP)をdeployし瘤の空置を行いました。次に弓部の嚢状瘤に対してLunderquist越しに本邦初公開のTX2 proform(ZTEG-2PT-40-158-PF)を挿入し、左SCAをcoverする形で留置しました。TX2 proformであるため、弓部の屈曲にフィットするかたちで留置することができました。しかし、左CCAを半分coverするかたちとなったため、左CFAから7Fr.シャトルシースを左CCAまで挿入し、SMART stent(10×40mm)を留置し左CCAの順行性血流を確保しました。左上腕動脈のカテーテルから左SCA起始部にOrbit 10mm 2個、14mm 5個を用いてコイル塞栓を行い、最終造影でエンドリークがないことと、椎骨-脳底動脈循環を介し左SCAが良好に造影されることを確認しました。術後経過は極めて良好で、脳梗塞もなく第6病日に退院となりました。術後1ヶ月の時点で術前に認めていた背部痛や嗄声症状が改善していることを確認し患者さんも大変喜んでいました。造影CT所見でも胸部・腹部ともにエンドリークを認めず、遠位弓部の嚢状瘤も5.3cmと縮小していました。遠位弓部にステントグラフトを留置した場合にはBird’s Beakが問題となりますが、TX2 proformは挿入、留置もきわめてスムースでBird’s Beakなく留置できることを改めて確認しました。従来のTX2ステントグラフトには一切手を加えずに、deploymentのメカニズムに一工夫するだけでこんなにも効果があるproformは素晴らしいアイデアだと感心させられました。遠位弓部瘤の多い日本での上市が待たれますが、Cookには待たされ慣れしているので、気長に待ちましょう。
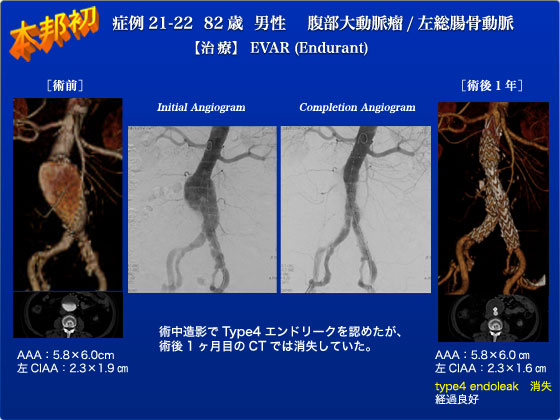
症例21,22は82歳の男性でAAA(6.0×5.8cm)とCIAA(2.3×1.9cm)の患者さんです。この症例は2012年8月現在シェアを伸ばしているEndurantステントグラフトの本邦初公開ライブでした。両側鼠径部をカットダウンし右よりメインボディを挿入し至適位置で留置しました。ステントの留置方法は胸部用のTalentと同様の操作で行うことが可能で非常に簡便でした。左CIAは解離瘤を伴いやや太めでしたがEndurantのlegは28mmまでのサイズバリエーションがあり、以前はEIAに留置しなければならないような症例もCIAに留置することが可能でした。最終造影ではEndurantでは多く認められるtype4エンドリークを認めましたが、術後1カ月の造影CTでは消失していました。1年後の現在でも患者さんは、元気で造影CTでもエンドリークはなく、動脈瘤も増大を認めておりません。まさにEndurantは正確な留置ができるうえに屈曲にも対応可能でZenithとExcluderの良い点を合わせたbest of both worlds的ステントグラフトと言えます。現在シェアを広げているのも納得のステントグラフトです。なお、Type 4エンドリークであれば我々の経験では1か月後の造影CTで全例で消失しておりますので、鑑別診断さえ間違わなければ術中Type 4エンドリークは放置していいと断言できます。
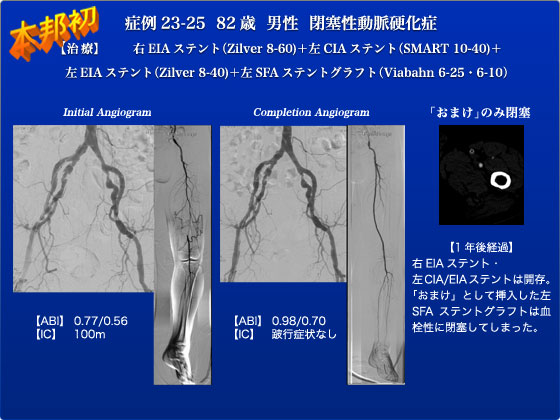
症例23-25は82歳の男性で、Fontaine II 度、Rutherford Ⅰ-3(IC 50m左>右)の症例であります。CT上、右EIA 90%、左CIA 60%、左EIA 90%、左SFA 30cmCTOが認められました。通常であれば、inflowの改善目的に左右の腸骨領域の狭窄に対してPTA/stentを行い、症状の変化を経過観察するものと思われます。しかし、今回は、「おまけ」として、SFAのCTO病変を突破できたら、本邦初公開Viabahnステントグラフトを留置する予定としました。右鼠径部に5Frシースを留置し、まず右EIA病変に対してChevalier(0.014)を用いてlesion-crossさせ、Sterling4-20でpre PTAを行い、5Frシースでも挿入可能なZilver518の8-60を留置し、post PTAをSterling 6-20にて行いました。次に、7Fr ANSEL 1をstiff-wire越しに、左CIA病変を通過させ左EIA病変に対して、Wanda 4-40を用いてpre PTAを行った後、Zilver 8-40を留置し、Wanda 6-40を用いてpost PTAを行いました。左CIA病変に対してはSMART 10-40を留置し、PowerFlex P3 8-20でpost PTAを行いました。この時点で、inflowの血流はかなり改善されましたが、時間的ゆとりが若干残っていたため、左SFA病変に対して治療を行うこととしました。ANSELの先端を山越に左CFAまで進め、30cmのSFA CTO病変に対して、アスリートルビー(0.014)、Astato(0.014)、Tresure(0.014)、Tornus(2.1Fr)と様々なワイヤを用いましたが、通過困難であり、かつtrue lumenに挿入されませんでした。しかし、X-treme(0.014)・KMPカテーテルを用いたsub-intimal techniqueにて何とかlesion-crossし、膝上でtrue lumenに戻ることができました。Viabahn 6-25と6-10をDFAの血流を温存するように留置し、Viabahnを使用したいわゆる「血管内F-Pバイパス」に成功しました。術後経過も順調で、ICもなくなり第3病日には退院となりました。術後1年の経過で、ICはなく両側腸骨動脈ステントは開存しておりましたが、「おまけ」として留置したViabahnステントは残念ながら閉塞しておりました。それでもICが改善されたということは、腸骨動脈領域の狭窄を解除した効果が大きかったためと思われます。そのため「おまけ」手術はあくまでも「おまけ」であり、したがって閉塞した時点でのダメージはありませんでしたので経過観察を行っております。
2012年8月現在、さらに進化したヘパリンコーティングのViabahnの治験を施行していますが、我が国においてもこのデバイスが早く使用できるように他の治験施設の協力を得ながら頑張っております。
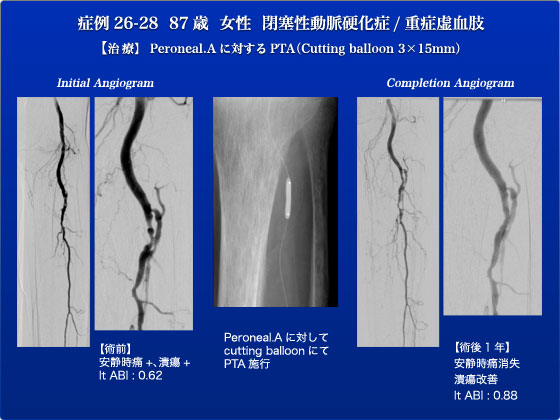
症例26-28は重症下肢虚血の症例です。2011年1月に重症下肢虚血による右足趾潰瘍に対して前医で右大腿?膝窩動脈バイパス(FP bypass)を施行されました。一度は軽快したものの同年7月より両足趾潰瘍が出現し当科紹介となった症例です。FP bypassはpatentでした。はじめに、ややSFA,DFAの分岐が高いため左CFAをマイクロパンクチャで穿刺し、造影しながらprogradeにシースを挿入しました。KMP+Renegade+0.014ワイヤーで脛骨腓骨動脈管の病変を通過させCutting balloonでPTAを行いました。狭窄はなくなり左足部の造影も改善されました。術後経過良好で下肢の潰瘍改善しABIも術前0.62から0.71まで改善しました。先日の術後一年の外来診察でもABIは0.88であり、潰瘍、安静時痛の再燃などはみとめておりません。このようにバイパス後で伏在静脈がない場合はインターベンションが有効です。
JES 2011も皆様のご協力を得ながら無事終了しました。第6回まで通算140例のライブ手術を行いましたが、死亡例はありません。術中合併症も初年度の頸動脈ステント術の術中に生じた網膜梗塞以来5年ぶりにTEVAR術後1日の脳梗塞に遭遇しましたが血栓除去により事なきを得ました。血管病治療において脳梗塞が鬼門であることが見て取れます。また、ライブ手術では造影剤が増える事が指摘されていますが、140例のJES症例で術後contrast induced nephropathyに陥った症例がないことは良い知らせです。毎年こうして全例を振り返っていますが、当時本邦初で行ったものが現在一般に広く行われるようになったことにおいてもこのJESの意義があるのではないかと思っております。
JES 2012でも、皆さんのご協力を得ながら一層、質が高く安全で教育的なライブ中継を通して「JESは血管病治療のクリスタルボール」を実現したいと願っています。数多くのnew deviceやnew techniqueが目白押しですのでご期待ください。なお、余談ですが、本日は私の50回目の誕生日です。「やっとここまで来たか。やせ我慢ももう少しの辛抱」というのが率直な感想です。(2012年8月12日記)
Japan Endovascular Symposium研究会
実行委員長 大 木 隆 生
- 医療ルネサンス(読売Online) [ 医療ルネッサンスTV / 頚動脈ステント術 / 大動脈ステントグラフト術 / 閉塞性動脈硬化症の治療 ]
- ニューズウィーク誌 [ Newsweek 2000-1.19 私たちが世界標準だ / 2006-10.18 世界が尊敬する日本人100人 ]

